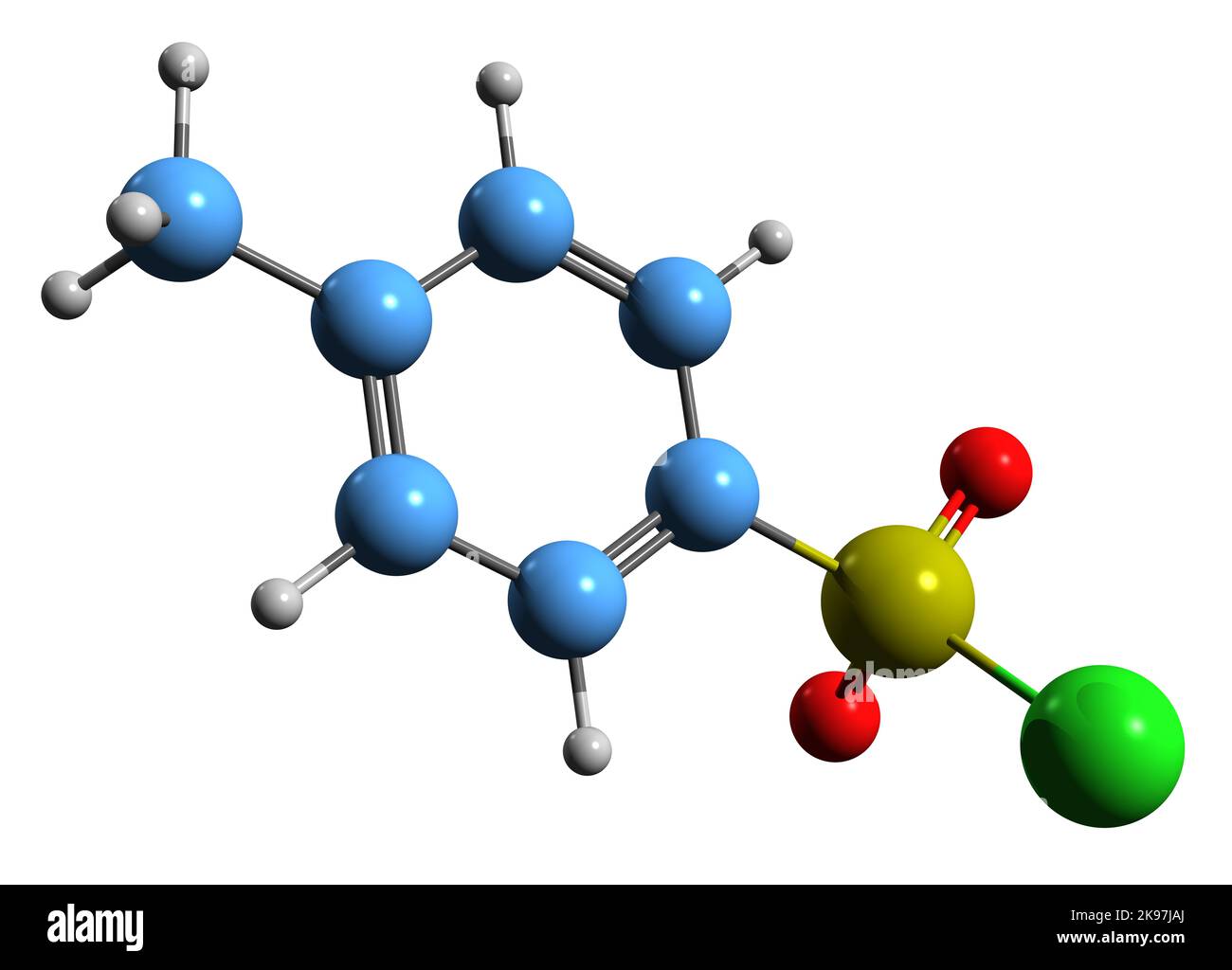
Il cloruro di solforile, SO2Cl2, è un ossialogenuro dello zolfo esavalente, formato idealmente dall'unione del gruppo bivalente solforile >S(=O)2 con due atomi di cloro; può anche pensarsi ottenuto dall'acido solforico per sostituzione dei due ossidrili con due Cl. Di qui, in alcuni testi lo si trova indicato anche come il cloruro dell'acido solforico.
A temperatura ambiente si presenta come un liquido mobile e incolore che fuma all'aria, dall'odore pungente. Analogamente al cloruro di tionile, l'analogo con lo zolfo(IV), non lo si trova in natura per la sua elevata tendenza a subire un'idrolisi che porta rapidamente ad acido solforico e acido cloridrico, secondo la violenta reazione seguente:
Per questo i suoi vapori sono fortemente irritanti e lacrimogeni.
Struttura
Nella molecola SO2Cl2 un atomo di zolfo è al centro di un tetraedro distorto; due vertici del tetraedro sono occupati da due atomi di cloro uniti a S con legame semplice; gli altri due vertici ospitano due atomi di ossigeno uniti a S con doppio legame, come di solito viene rappresentato o, secondo altri, con legame dativo S-->O; in ogni caso, la lunghezza di questo legame (143 pm) è notevolmente minore di quella tipica per un legame semplice (157,4 pm in S-OH di H2SO4) ed è consistente con un ordine di legame di 2. L'atomo centrale S è sostanzialmente ibridato sp3; l'angolo O-S-O è notevolmente più ampio di quello tetraedrico, mentre quello Cl-S-Cl lo è solo di pochissimo: ciò risulta in accordo qualitativo con le previsioni della teoria VSEPR che assegna maggior spazio angolare al legame doppio rispetto al legame semplice. Il risultato per la molecola è di un abbassamento della simmetria da Td a C2v, conferendo quindi alla molecola la simmetria del bisfenoide. SO2Cl2 è una molecola polare, μ = 1,81 D,ben più del cloruro di tionile SOCl2 (1,45 D). La molecola è isoelettronica di valenza con il cloruro di selenoile (SeO2Cl2) e il cloruro di cromile (CrO2Cl2), ma anche con il fluoruro di solforile (SO2F2).
Il liquido, di modesta costante dielettrica (εr = 10), è solubile in etere, benzene, toluene, CHCl3, CCl4 e acido acetico glaciale.
Sintesi
Il cloruro di solforile viene sintetizzato, in condizioni controllate di pressione e temperatura, a partire da anidride solforosa e cloro gassosi utilizzando come catalizzatore il carbone attivo:
Il prodotto impuro può essere purificato per distillazione frazionata.
Si ottiene anche per ossidazione di cloruro di zolfo con ossigeno in presenza di cloro o per decomposizione termica (180 °C) di acido clorosolforico. In ogni caso il cloruro di solforile grezzo viene purificato per distillazione frazionata.
Usi
Il cloruro di solforile è utilizzato nella sintesi chimica in qualità di fonte di cloro, più pratico e maneggiabile rispetto all'alogeno. I suoi usi principali riguardano la formazione di α-alogenuri di composti organici attivati dalla presenza di carbonili (R2C=O) o solfossidi (R2S=O), ma anche di cloroderivati di altri composti quali gli idrocarburi e gli epossidi. SO2Cl2 è anche in grado di reagire con gli alcoli producendo cloruri alchilici.
Reazioni
Mettendo a contatto con l'acqua il cloruro di solforile si ha una violenta reazione chimica che produce acido solforico liquido e acido cloridrico gassoso.
Alla temperatura di 100 °C inizia a decomporsi in cloro e anidride solforosa. Con zolfo a 200 °C si formano cloruri di zolfo e anidride solforosa; con acido solfidrico reagisce dando zolfo, anidride solforosa, acido cloridrico e cloruro di zolfo; con acido solforico concentrato a 700 °C si forma acido clorosolforico mentre con ammoniaca in eccesso si ottengono cloruro di ammonio e derivati solfonammidici.
In ambito industriale viene principalmente utilizzato per la produzione di pesticidi e nell'industria tessile per evitare il restringimento della lana.
Note
Voci correlate
- Cloruro di tionile
- Cloruro di cromile
Altri progetti
- Wikimedia Commons contiene immagini o altri file su Cloruro di solforile
Collegamenti esterni
- (EN) sulfuryl chloride / sulfonyl chloride, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.